钾离子通道是目前发现分布最广、亚型最多的一类离子通道,存在于几乎所有真核生物中并发挥多种生物功能。钾通道的功能异常会导致长QT综合征、糖尿病和哮喘等多种累及心脏、胰腺、肾脏和中枢神经系统等部位的严重疾病。电压门控钾离子通道(voltage-gated potassium channels,Kv)是一类经典钾离子通道,它的开启和关闭由膜电位决定并与电位变化时间有关,因此在维持可兴奋细胞动作电位方面起着非常重要的作用。
通道失活是通道门控过程中的一个重要环节,理解通道的失活机制对于明确通道的生理和病理功能十分关键。通常情况下,在电压条件下钾离子通道会打开激活门并通透离子传导数百毫秒,之后通道就会自动关闭,停止离子传导,使通道失活。离子通道的失活的快慢是影响靶向离子通道的药物动力学的重要因素,因此,离子通道的失活机制,特别是C-型失活,一直是生理和药理学都关注的重点,但是长期以来没有明确的机制解释(图1)。
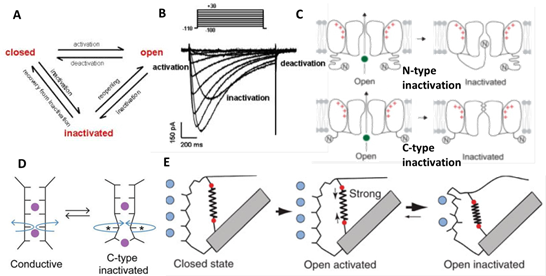
图1. 离子通道失活是通道的重要属性。(A) 离子通道在“关闭-开放-失活”三个状态之间进行循环;(B) 在电压维持下,离子通道会自发失活。不同通道有不同的失活速率;(C) 离子通道失活主要有两种形式(N-型,C-型)。N-型失活主要有N端结构域在胞内堵住通道孔道,C-型失活主要体现在孔道过滤区的构想变化;(D) 有的C-型失活机制被认为是孔道过滤区的缩紧;(E) 有的C-型失活机制被认为是孔道过滤区氨基酸侧链间的相互作用
Kv1.3通道是Kv家族成员之一,最早是在人的T淋巴细胞中被发现的,它在免疫系统、神经系统和血管平滑肌细胞中都有表达。Kv1.3是目前发现在T细胞中存在的主要钾离子通道之一,它的功能作用主要体现在对细胞膜电位的调节上。在抗原的呈递过程中,Kv1.3通道聚集在免疫细胞突触上并促进Ca2+信号传导(图2)。研究表明,Kv1.3主要参与效应T细胞的激活过程,因此不同亚型的T细胞对Kv1.3抑制剂的敏感程度也不同。选择性的抑制Kv1.3通道,就可能达到选择性的抑制效应T细胞激活过程的作用,这为与效应T细胞相关的自身免疫性疾病的治疗提供了新的思路。Kv1.3也因此成为治疗自身免疫性疾病的新型靶标蛋白。除此之外,Kv1.3还参与了机体的神经毒性效应以及癌症的发生发展等过程,在乳腺癌、前列腺癌、卵巢癌和小胶质细胞瘤等多种肿瘤细胞表明都检测到了Kv1.3的异常表达。实验表明,抑制Kv1.3的活性可以诱导肿瘤细胞的凋亡[1]。因此,以Kv1.3为靶点的药物研究具有重要的临床价值。
图2. Kv1.3在T细胞活化中的作用及其在免疫细胞突触上的聚集[2]
目前已发现的Kv1.3抑制剂主要分为小分子化合物、动物毒素和防御素(defensin)三大类。相比于小分子化合物,毒素的作用方式更加特异和高效,且分布广泛,资源丰富,是多肽药物开发的重要宝库。作用于Kv1.3的毒素包括多种蝎来源的margatoxin(MgTX),charybdotoxin(ChTX),kaliotoxin(KTX), noxiustoxin(NTX)和agitoxin-2等多肽,海葵毒素ShK以及来源于蛇的BF9毒素等。其中ShK含有35个氨基酸,形成3对二硫键,具有两段较短的α螺旋结构。ShK对Kv1.3的亲和力很强,可以在皮摩尔级别的浓度下抑制通道电流,但是它对其他Kv1.x家族成员也有抑制作用。为了提高对Kv1.3的选择特异性,研究人员在ShK的基础上进行改造产生了一系列ShK的类似物,如ShK-Dap, ShK-186, ShK-192等,其中ShK-186(Dalazatide)已完成一期临床试验,结果表明该多肽具有良好的耐受性,能抑制血液中的炎症介质,从而改善银屑病患者的皮肤损伤[3]。
2021年6月1日,中国科学技术大学田长麟课题组和南京大学董昊课题组合作,在Cell Discovery杂志上发表了题为“Structures of wild-type and H451N mutant human lymphocyte potassium channel Kv1.3”的研究论文。该论文报道了人源Kv1.3-Kvβ2.1复合物(正常失活速率)和H451N突变体-Kvβ2.1复合物(快速失活突变型)的冷冻电镜三维结构(图3)。
图3. 人源Kv1.3-Kvβ2.1复合物和Kv1.3 H451N突变体-Kvβ2.1复合物的冷冻电镜三维结构
Kv1.3的整体结构与同家族的Kv1.2亚型非常相似。然而,在电压感受结构域(VSD)中,它们在连接S5和S6螺旋的环区域有差异,该区域与毒素配体的结合密切相关,这种结构上的差异可能是导致Kv1.3和Kv1.x其他亚型对堵孔毒素的敏感性不同的原因。
在野生型(正常失活速率)和突变体(快速失活速率)的选择性过滤器中,四个经典钾离子配位处对应的密度不是都同时存在的。通过结构比对发现,与野生型Kv1.3相比,快速失活突变体(H451N突变)的选择性过滤器靠近胞外的上半部分发生了明显的扩张。这种扩张不仅由该区域氨基酸残基的向外移动引起,同时G446和Y447的羰基也发生了旋转导致其碳基氧原子偏离孔道的中心轴。进一步的分子动力学模拟实验表明,在该突变体中,由于稳定孔道的氢键作用网络被削弱而引起外部孔道区域发生扩张,最终导致孔道的失活(图4)。
图4. 结构比对和动力学模拟表明H451N突变改变了W436与D 449之间的H-键相互作用,而使得快速失活性突变体之间的H键网络被弱化
综上所述,田长麟/董昊合作报道了人淋巴细胞Kv1.3通道和快速失活突变体H451N的冷冻电镜结构,在这两种结构中,VSD处于去极化构象,孔道下方的内门是开放的。由于选择性过滤器中离子的不完全占据,以及该区域Y447和D449氨基酸残基侧链的弱电子密度,野生型和H451N突变体Kv1.3的结构可能都与C型失活构象有关。该研究为设计新的可作为免疫调节剂的Kv1.3抑制剂提供了结构基础。
本研究工作由中国科学技术大学的田长麟团队和南京大学的董昊团队通力合作共同完成,并得到了新加坡南洋理工大学George Chandy教授的指导。中国科学技术大学生命科学学院的副研究员刘三玲、博士研究生赵越和南京大学教授董昊为论文的共同第一作者,中国科学技术大学的田长麟教授、张隆华副教授和南京大学的董昊教授为本文的共同通讯作者。
参考文献
1.Leanza, L., et al., Inhibitors of mitochondrial Kv1.3 channels induce Bax/Bak-independent death of cancer cells. EMBO Mol Med, 2012. 4(7): p. 577-93.
2.Chandy, K.G. and R.S. Norton, Peptide blockers of Kv1.3 channels in T cells as therapeutics for autoimmune disease. Curr Opin Chem Biol, 2017. 38: p. 97-107.
3.Tarcha, E.J., et al., Safety and pharmacodynamics of dalazatide, a Kv1.3 channel inhibitor, in the treatment of plaque psoriasis: A randomized phase 1b trial. PLoS One, 2017. 12(7): p. e0180762.
原文链接:
https://www.nature.com/articles/s41421-021-00269-y

