目前,对α7的功能和药理学性质已有广泛的研究,但α7的结构信息知之甚少。α7结构方面的认知主要还是来自于α7-AChBP嵌合体胞外域晶体结构和α7跨膜区的NMR结构,以及其他亚型乙酰胆碱受体的结构(α4β2-和α3β4-nAChR,muscle-type Torpedo AChR)。实际上,不同亚型的乙酰胆碱受体具有不同的生理功能和特性,但它们的正构位点都是由一些相对保守的芳香族氨基酸组成的疏水口袋,因此鉴定序列和结构上有差异的氨基酸将是影响激活机制的关键因素。此外,PAM在α7上的结合位置尚不明确,PAM的别构调节机制目前还不够清晰。这些问题都需要完整的α7以及α7-配体复合物的高分辨率结构来解答。
近日,中国科学技术大学田长麟课题组与清华大学刘磊课题组合作,在Cell Research杂志上发表了题为 Structural basis of human α7 nicotinic acetylcholine receptor activation 的研究论文。该论文报道了人源全长α7受体在三种状态下的冷冻电镜三维结构(图2):不添加任何配体的(apo form)的resting状态结构(3.18 Å);结合激动剂(EVP-6124)的脱敏状态结构(2.85 Å);同时结合激动剂(EVP-6124)和正向别构调节剂 (PNU-120596)的部分脱敏状态结构(3.02 Å)。
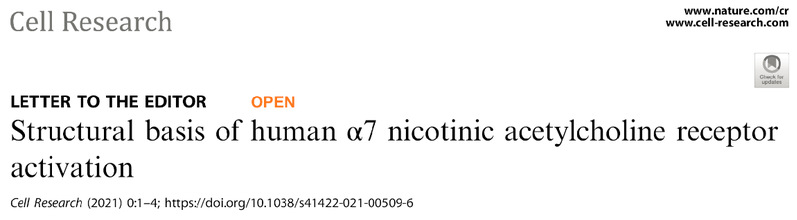
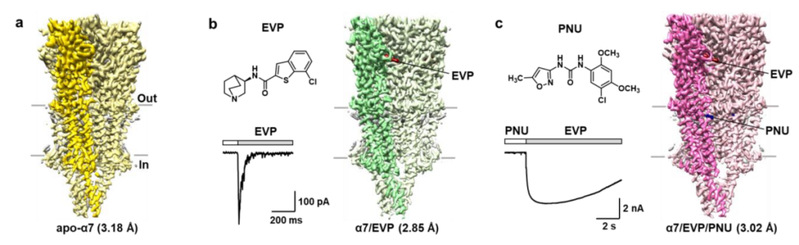
人源全长α7受体在三种不同状态下的冷冻电镜三维结构
田长麟/刘磊合作报道的研究结果展示了不同配体结合状态下α7乙酰胆碱受体原子分辨率的三维结构,清楚地揭示了激动剂和正向别构调节剂(PAM)与α7的结合模式及选择性的结构基础,同时也揭示了α7受体激活的分子机制。作为独立开展的研究工作,田长麟/刘磊组与Hibbs组的研究结果高度互补,揭示α7受体的配体激活机制,将为靶向α7受体的药物开发提供重要的结构信息。
本研究工作由中国科学技术大学的田长麟团队和清华大学的刘磊团队通力合作共同完成。中国科学技术大学生命科学学院的博士研究生赵越、副研究员刘三玲和博士研究生周颖欣为论文的共同第一作者,中国科学技术大学的田长麟教授、孙德猛副研究员、刘三玲副研究员和清华大学的刘磊教授为本文的共同通讯作者,中科院上海药物所徐华强研究员给予了非常宝贵的指导意见。
原文链接:
https://www.nature.com/articles/s41422-021-00509-6

